So what?
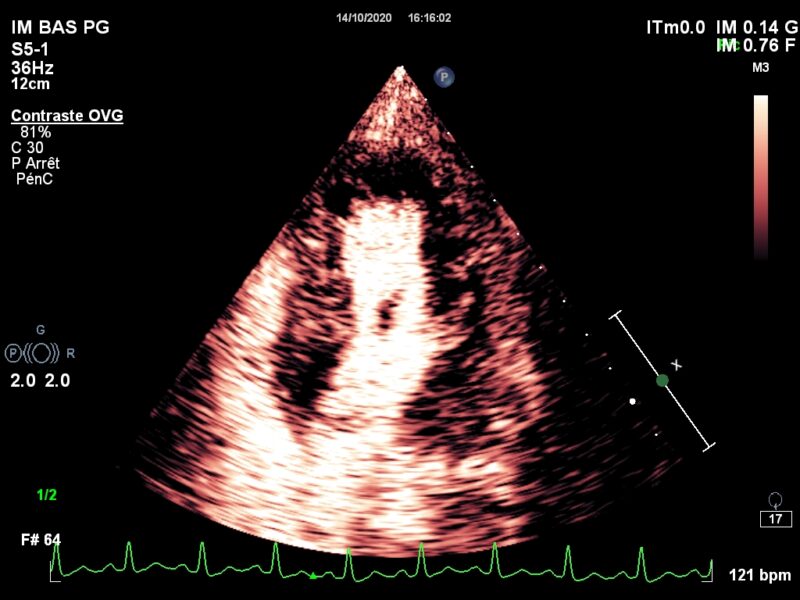
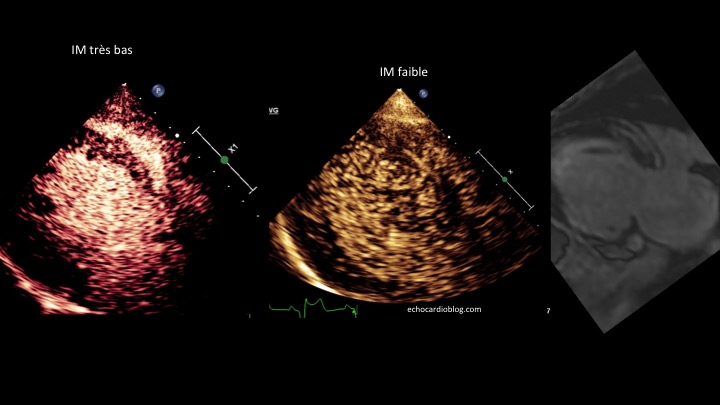
Dans un ventricule gauche, une boule : Ça pourrait être plein de chose, une tumeur, peut-être un thrombus, mesuré à 9 mm de diamètre, (découvert d’un bilan d’AVC). Complétons avec un injection de contraste : Pas de zone akinétique, FEVG normale. Avec un indice mécanique bas, étude de la perfusion : La perfusion est normale, …