L’insuffisance cardiaque est-elle une maladie rénale?
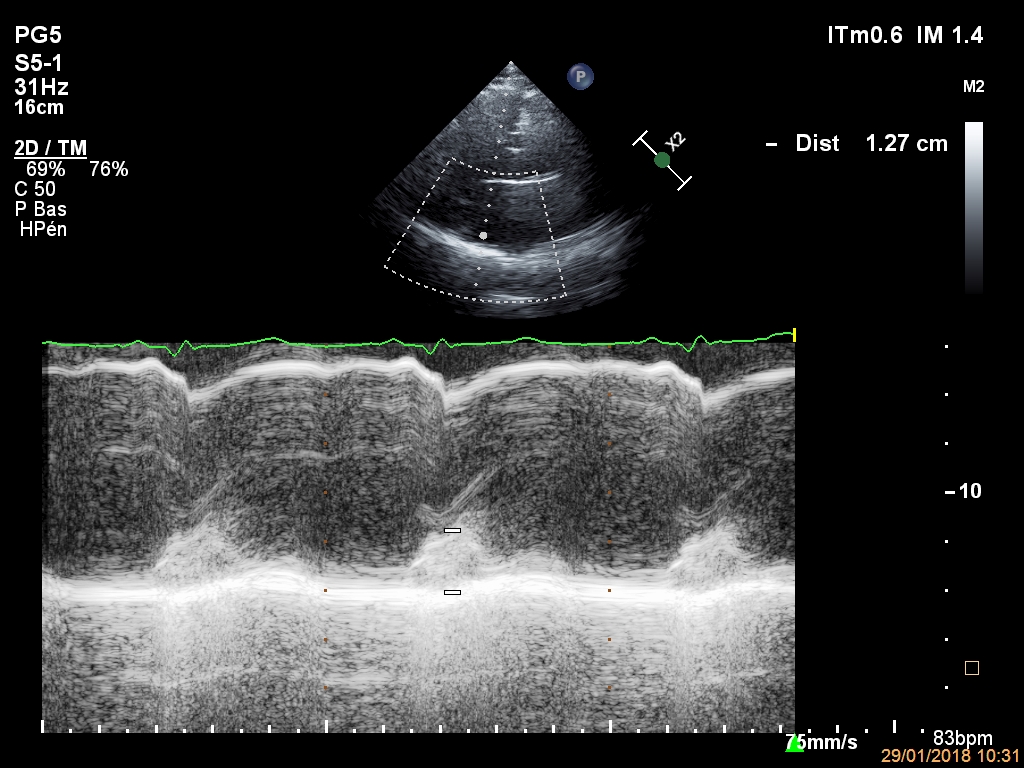
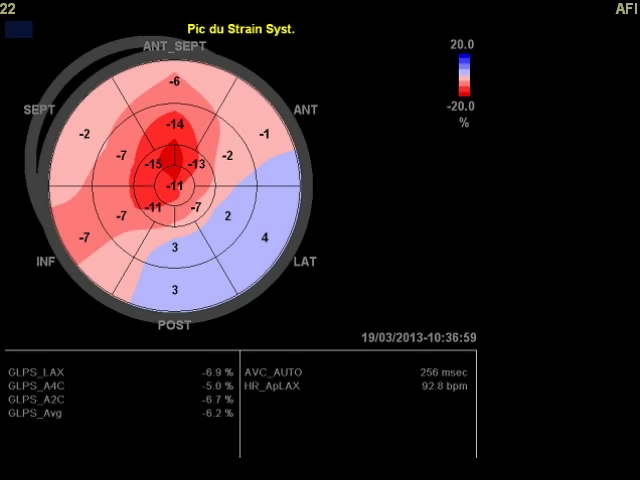
Dans ce cas clinique, je vous proposais l’histoire d’un patient en rémission d’un lymphome, avec une cardiomyopathie toxique compliquée d’une insuffisance mitrale sévère (si on retient les 20 mm2 de SOR pour les IM secondaires), d’une dysfonction atriale et annulaire mitrale. Les solutions envisagées par mes commentateurs préférés (que je remercie au passage) sont les …