So you think ’21 is gonna be a good year?
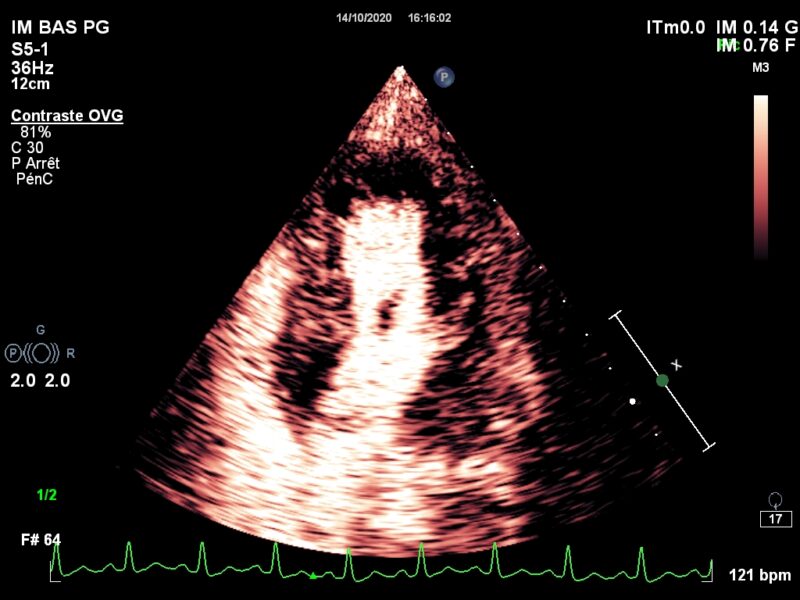
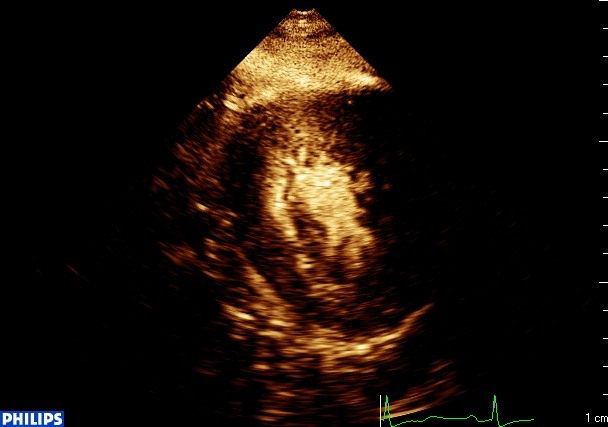
Pour finir l’année et le cas clinique, un dernier message 2020. Il s’agit d’une ischémie limitée lors d’une échographie de stress pour dépistage de maladie coronaire. Lors de l’analyse de perfusion, le défect au pic du stress apparait cependant beaucoup plus large, intéressant largement la paroi antérieure et apicale : Compte tenu d’une probabilité pré-test …