Le trieur de forme
Le trieur de forme est devenu un grand classique de l’éveil de bébé. Le cardiologue, qui à bien des égards est resté un grand enfant (avec une liste de Noël remise à jour plus souvent que son CV), a pourtant oublié les enseignements essentiels de ce jeu.
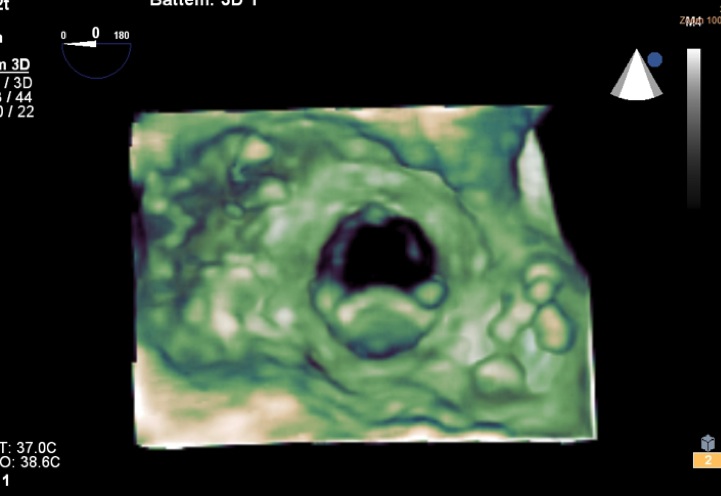
La fuite périprothétique peut être punctiforme, (dans une zone où les points séparés ont lâché), plus fréquemment il s’agit d’une véritable déchirure d’un anneau (qui était fragilisé par des calcifications ou une endocardite…) La fuite ponctiforme est souvent de petit volume et génère des hémolyses importantes. La déhiscence est souvent plus large et engendre des fuites plus volumineuses qui sont en général symptomatiques sous forme d’insuffisance cardiaque. La forme de cette déhiscence est souvent un croissant. La fermeture percutanée des fuites périprothétiques repose donc sur un pari, celui de superposer des prothèses rondes dans un orifice en forme de croissant pour tenter d’une part d’obtenir une étanchéité de la valve et d’autre part de limiter l’hémolyse.
Si l’on revient au patient du cas clinique précédent, on voit parfaitement sur les images 3D de la face auriculaire de la prothèse qu’il existe une large déhiscence en forme de croissant sur une quasi hémicirconférence. La prothèse bascule avec une mobilité anormale qui témoigne de l’importance de cette déhiscence. Compte tenu de l’âge du patient, la chirurgie redux n’a pas été retenue. Le patient a donc été référé pour une tentative de fermeture percutanée. La vidéo suivante montre le passage du guide au travers de l’orifice périprothétique (en bas à gauche) :
3D guide fuite peri (converti) from fish Nip echocardiographie on Vimeo.
Sur cette vidéo on voit un Amplatzer mise en place (en bas et à gauche de l’écran) et qui ne parvient pas à fermer la totalité de l’orifice. On peut donc parler d’un succès partiel (pour ne pas utiliser les termes choquants d’échec incomplet) :
protheĖse periprotheėtique (converti) from fish Nip echocardiographie on Vimeo.
Pour illustrer ces difficultés à fermer des orifices en croissant avec des bidules ronds, je vous joins une expérience plus personnelle d’un patient présentant également une fuite périprothétique sur une bioprothèse responsable également d’une hémolyse importante, non contrôlée par les supplémentations diverses et l’EPO, avec nécessité de transfusion itératives. Sur la vidéo on peut voir assez nettement de fuite à 10 heures en vue chirurgicale, proche de l’auricule, un peu plus importante, et l’autre beaucoup plus petite, à 2 heures en vue chirurgicale.
3fuites from fish Nip echocardiographie on Vimeo.
Comme on pouvait s’y attendre seule la plus grosse a pu être fermée et l’on voit sur cette vidéo l’Amplatzer occluant parfaitement l’orifice (avec toutefois un flux entre les deux disques dont on peut se demander s’il n’est pas lui-même la cause d’une hémolyse persistante). Quoiqu’il en soit, l’hémolyse n’a pas disparue.
face Aur from fish Nip echocardiographie on Vimeo.
1 from fish Nip echocardiographie on Vimeo.
Quand on regarde d’un peu plus près la prothèse sur le versant cette fois ventriculaire, on peut également s’apercevoir que l’ouverture de la bioprothèse est gênée par le disque ventriculaire de l’Amplatzer. On peut également se poser la question du rôle de cette cusp immobile dans une hémolyse!
Face auriculaire :
face au from fish Nip echocardiographie on Vimeo.
Face ventriculaire :
face vent from fish Nip echocardiographie on Vimeo.
En conclusion, dans notre deuxième exemple, l’orifice est petit et l’Amplatzer peut gêner le fonctionnement de la bioprothèse, dans le premier exemple, l’orifice est grand et il est bien difficile d’obtenir un résultat parfait. La technique est cependant tentante et il existe probablement des bonnes indications. Le risque est infiniment plus faible que celui d’une chirurgie redux, le plus gros risque étant finalement l’échec de la procédure avec un retour à l’état de base (le fameux succès partiel).
Comme pour tous les enfants, la gestion de la frustration chez le cardiologue est bien difficile. J’espère pouvoir vous montrer des cas plus convaincants, en attendant je serais très heureux d’avoir votre sentiment sur la technique et des retours de votre expérience sur ce genre de cas.
À très bientôt,
Philippe
PS : ce post est trop long, je félicite chaleureusement ceux qui ont tenu jusqu’au bout!

que tes images sont belles!!! j’hésite toujours à faire de la couleur en 3D en raison de la cadence image mais j’avoue que tes images sont convaincantes.
Ce n’est pas toujours le cas… Il faut passer en acquisition 4 cycles, ça aide un peu, et serrer au maximum le zoom sur la région d’intérêt. Je ne me sert jamais du 3d couleur seul, mais ça aide à s’assurer que le defect que tu vois en 3d et bien un orifice de fuite et pas juste une zone plus fine ou un artefact du 3d.
Bonsoir. Perso je n’utilise presque plus jamais le 3D zoom, mais le 3D live. Plus de chipotages mais un résultat bien meilleur avec un peu d’habitude.De plus, si je ne dois pas faire de quantification, mais situer de façon précise une fuite, au lieu de le faire sur 4 cycles, j utilise le « hvr » (high volume rate). Cela permet d’éviter les artefacts de reconstruction et d’obtenir une cadence élevée sur un seul cycle. On perd par contre pas mal en résolution spatiale, donc les mesures faut éviter. Et bien sûr comme dit Philippe, serrer au max la région d’intérêt. Tellement ludique que j’y passe des heures quand le patient dort… 🙂
Bonsoir Axel, tu travaille sur un appareil GE?
Pareil, je trouve le 3D live assez surprenant à bien des égards, mais surtout pour la valve aortique. Tu arrive à mettre toute une mitrale dans un volume 3d live? Avec de la couleur? Je ne crois pas qu’on ai cette option « hvr » sur Philips?
Je vais m’entrainer! Merci pour le conseil 😉
Salut Philippe, non je travaille sur Philips, IE33 et Epiq7.
Si si, tu as certainement cette option HVR.
Oui on arrive à mettre toute la mitrale, en ouvrant les fenêtres (3d et couleur).
Je mets le moins de profondeur possible et, pour me placer, me mets d’abord sur un seul cycle, puis passe soit sur 4 cycles, soit HVR. Il faut ensuite utiliser le « plane crop » pour « rogner » la paroi auriculaire…
Perso je trouve le résultat bien supérieur au 3d zoom. Mais c’est plus long et difficile à mettre en oeuvre. Faut répéter et répéter…
Je bosse aussi sur GE, je leur préfère le 3D TTE et le strain. Mais en ETO, Philips a de loin ma préférence.
Bonne journée.
Merci Axel pour les tuyaux! J’ai hâte d’essayer 😉
Avec plaisir, as tu déjà essayé Siemens?
Sinon je ne sais pas comment insérer un commentaire dans la bonne rubrique concernant la sus sternale pascale, mais ce loop fait furieusement penser à une dissection A…
Super ce truc du 3d live! Je manque un peu d’entrainement mais c’est très intéressant!
J’ai essayé le sc2000 sans la sonde d’ETO (un seul exemplaire disponible, alors à l’essai à Bordeaux).
Pas super convaincu par l’ETT, très intéressé par l’ETO, surtout la modélisation aorte-mitrale sur tout le cycle, mais j’aurais bien aimé testé moi même! L’as tu essayé?
Ben non justement… Je l’ai vu à Londres en coulisses et à priori pas mal de points forts, très automatisé. Les gens de Bordeaux m’en ont dit le plus grand bien. J’espère le tester très prochainement car notre nouvelle salle hybride sera équipée par Siemens… Je laisserai mes impressions si ça se finalise.
Bonne soirée.
Tiens nous au courant!
Ils ont un logiciel de fusion pour la salle hybride?
Ils le développent, mais chut, c’est secret…