Freecloud
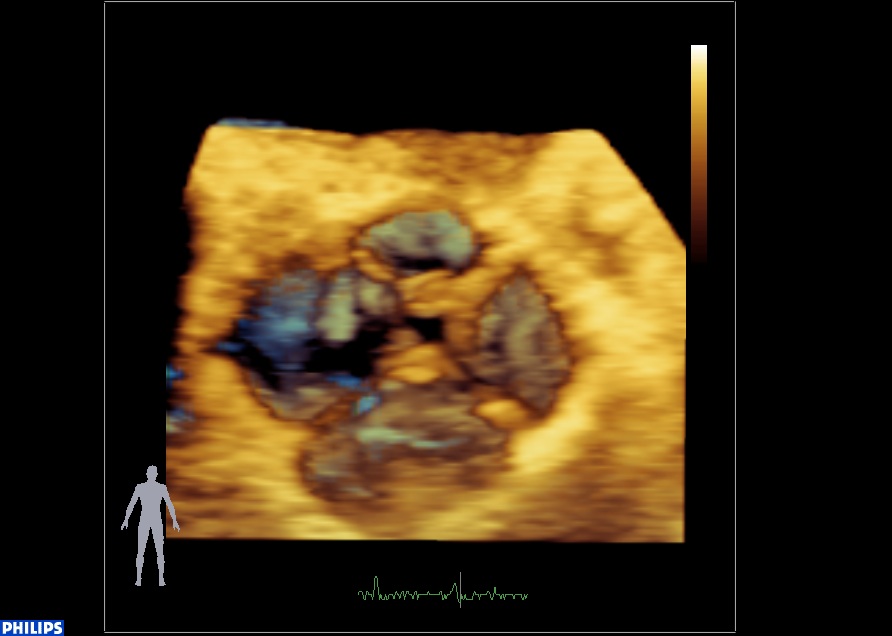
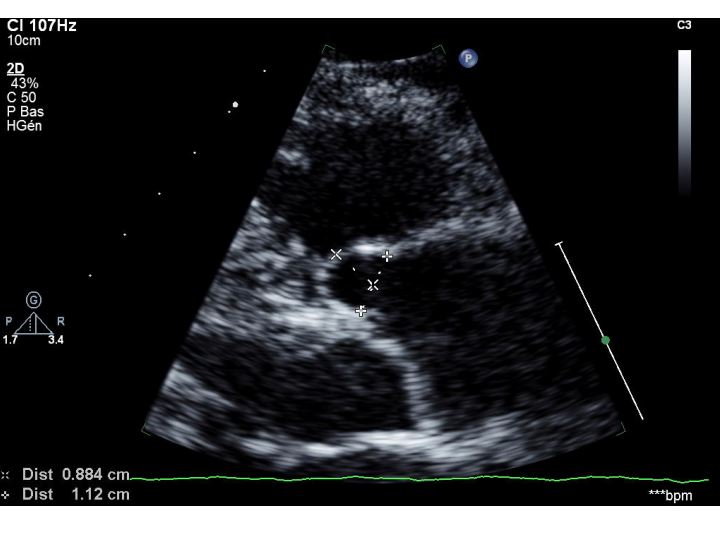
Merci à tous pour vos réponses à ce cas clinique, réponses qui résument bien les hypothèses possibles. Les cusps paraissent épaissies, la fuite est difficilement quantifiable mais la valve semble bien « poreuse »… L’aspect peut faire évoquer des végétations infectieuses, bien-sûr, mais comme l’ont écrit les collègues dans les commentaires, aussi un SAPL ou surtout une …