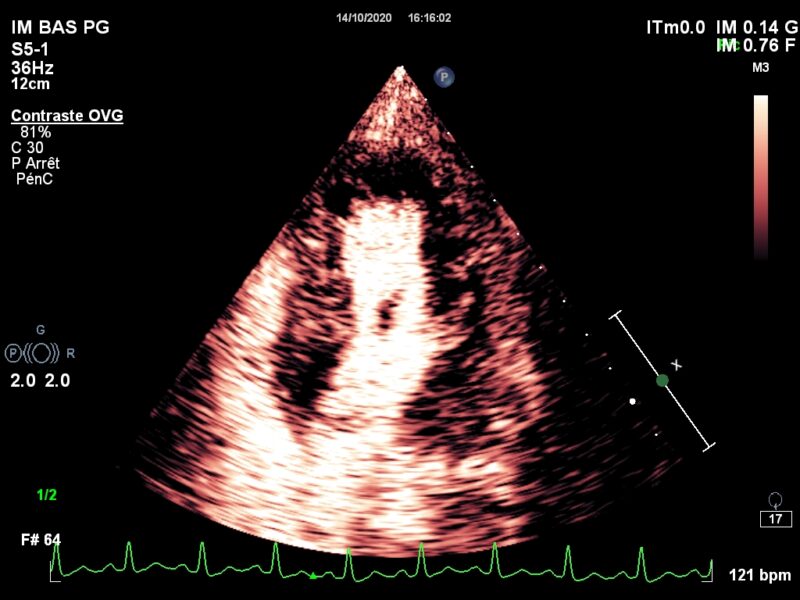
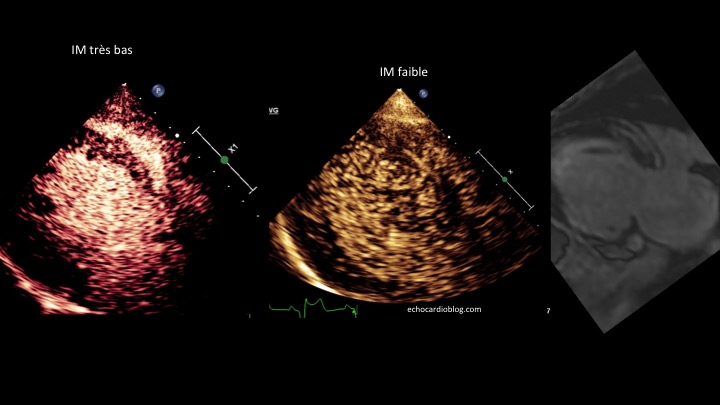
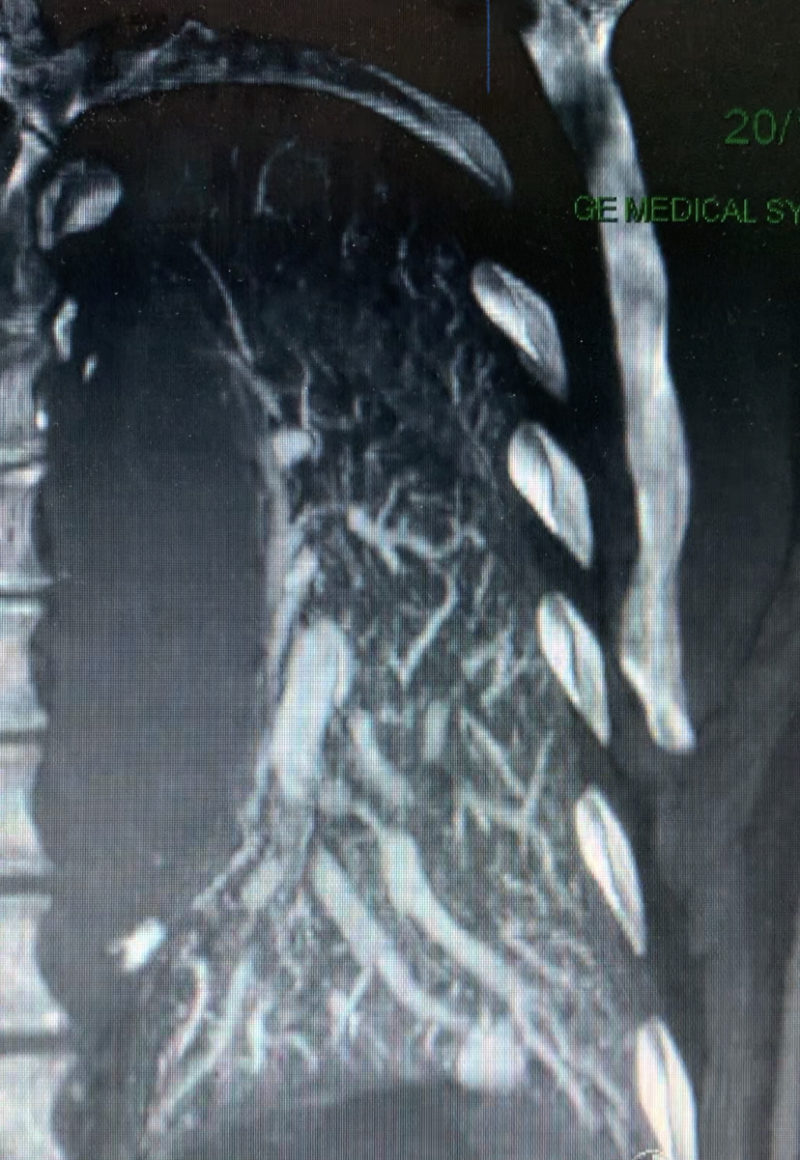
Le vaisseau fantôme (Viabilité et Perfusion)
Allez hop, dans la DeLorean, retour dans les années 2010, lorsque le blogging battait son plein. Voici donc un patient ayant constitué un SCA, un STEMI, une déstabilisation aiguë d’un syndrome coronarien chronique jusqu’alors asymptomatique, bref, un infarctus antérieur, en post-opératoire d’une chirurgie digestive. Média1.mp4 from fish Nip echocardiographie on Vimeo. La coronarographie réalisée à …