Suspicion sans suite ni suivi
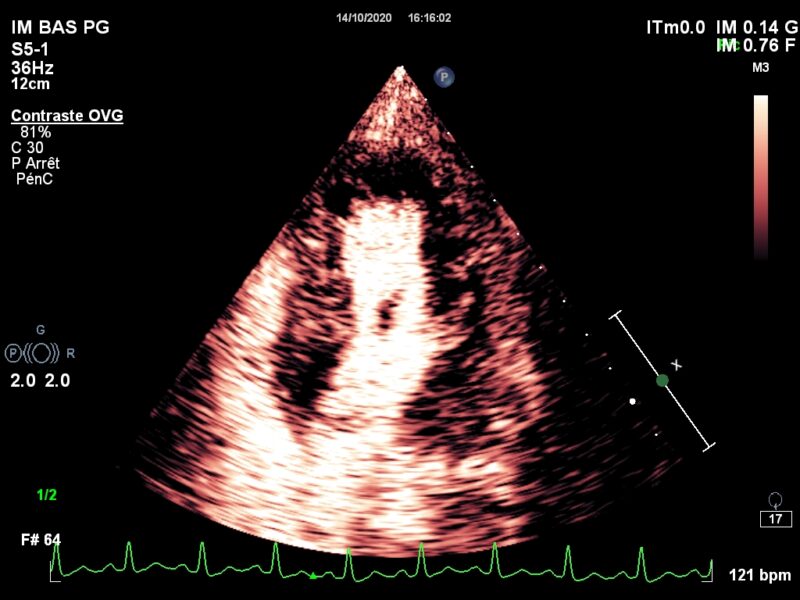
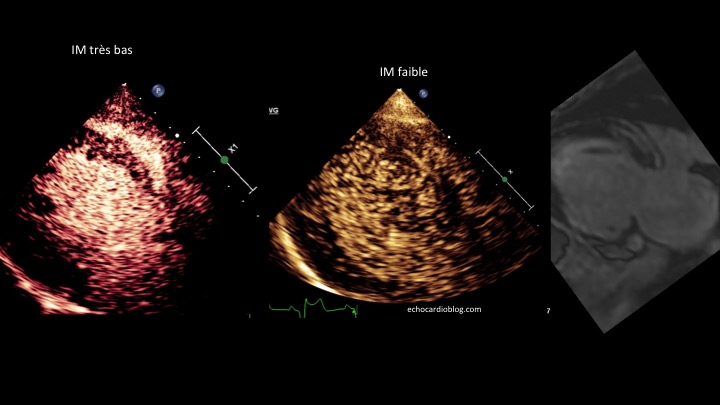
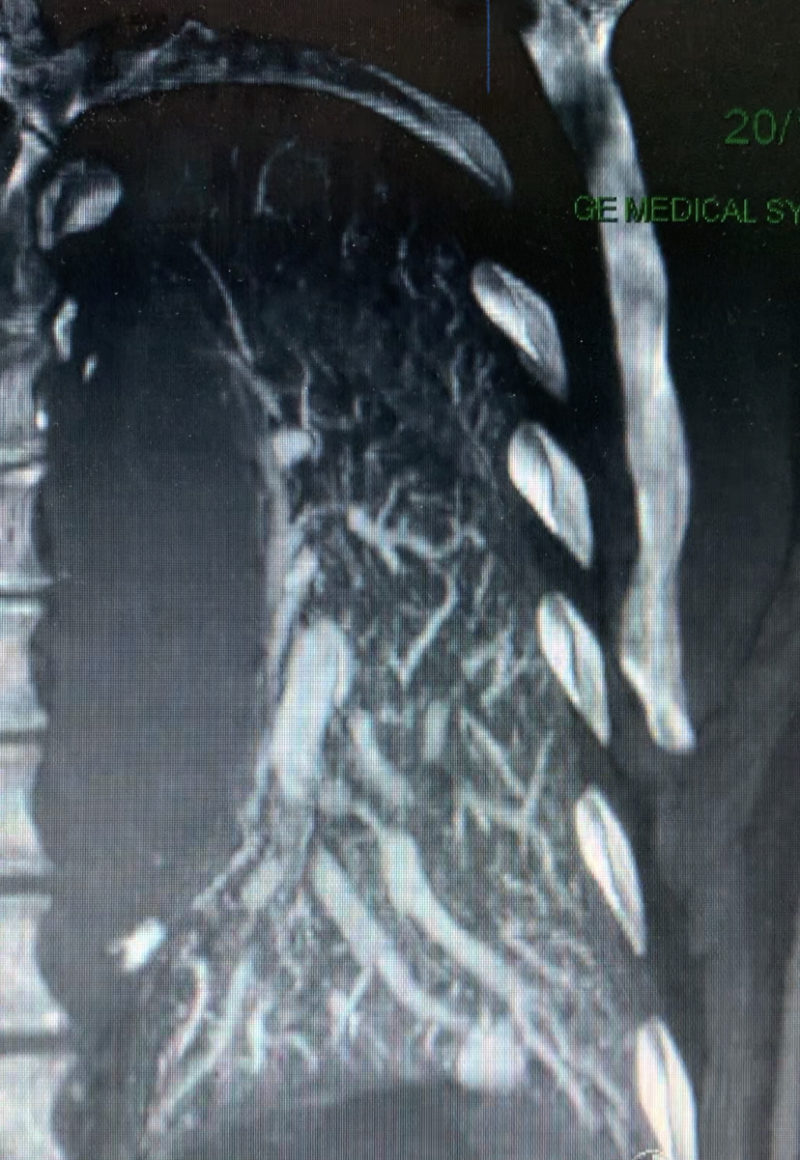
Convaincu par un mouvement social d’une certaine catégorie du personnel, je tente un retour de ce blog qui, avouons-le, a un peu perdu de son dynamisme ces derniers mois. En reprenant le fil, je m’aperçois que les derniers posts parlent beaucoup de contraste et de perfusion myocardique dont les applications multiples ne cessent de m’esbroufer. …